Responsable/s del laboratorio
intro
El grupo de Biología Estructural de Proteínas se centra en dos grandes líneas de investigación (i) las bases moleculares de la infección por Acinetobacter baumannii, un patógeno potencialmente peligroso, (ii) el mecanismo de reconocimiento de carbohidratos por las lectinas, implicadas en el desarrollo del cáncer.
Las enfermedades infecciosas son la principal causa de mortalidad en el mundo y constituyen un enorme reto para la salud pública. A pesar de los recientes avances aportados por diferentes estudios bioquímicos y estructurales de una serie de factores patogénicos, es necesario conocer más detalladamente las dianas asociadas con resistencia antibiótica y patogénesis bacteriana para poder combatir eficazmente este tipo de enfermedades. Las aproximaciones actuales se basan en dos estrategias, 1) la inhibición de aquellos componentes proteicos esenciales para la supervivencia bacteriana como son los que mantienen la integridad de la pared celular y, 2) la inhibición de los factores de virulencia. Nuestro objetivo es comprender mejor los mecanismos de patogenicidad desplegados por organismos gram-negativos (A. baumannii, P. aeruginosa, ...) mediante una aproximación estructural.
PRINCIPALES LÍNEAS DE INVESTIGACIÓN
β-lactamasas y sistemas toxina-antitoxina bacterianos. El número de carbapenemasas de clase D identificadas en hospitales de todo el mundo sigue creciendo de forma significativa. La mayor parte se han aislado de patógenos gram-negativos. Nuestros esfuerzos más recientes tratan de correlacionar las mutaciones exhibidas con resistencia en nuevas subfamilias de oxacillinasas para diseñar así estrategias de síntesis de nuevos antimicrobianos. Por otro lado, caracterizar el sistema toxina-antitoxina AbkA/AbkB en A. baumannii, relacionado con virulencia e implicado en la diseminación de plásmidos portadores del gen blaOXA-24/40-like, contribuyendo así a la estabilidad del plásmido.
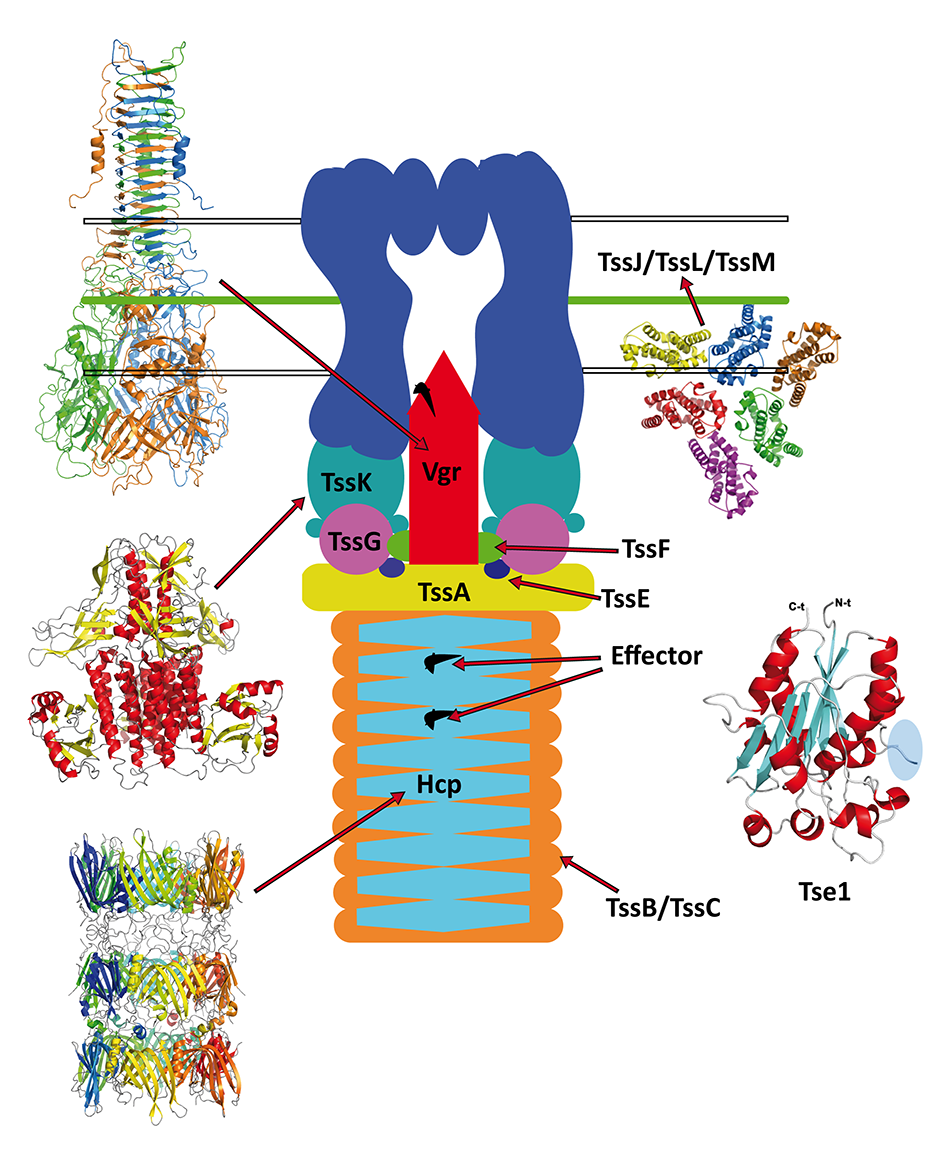
Sistema de secreción tipo VI (T6SS). Dada la complejidad de este sistema, hemos diseñado una estrategia para tratar de resolver cada componente individualmente y proceder a su ensamblaje posterior in silico. Hemos resuelto la estructura de Hcp (TssD) de A. baumannii caracterizando su estado de agregación mediante microscopía electrónica. Se produjeron anticuerpos policlonales específicos para Hcp demostrándose que el sistema T6SS es activo y funcional en la cepa AB0057, y en varias cepas clínicas nosocomiales de este organismo. Recientemente reportamos la estructura cristalina de VgrG1 de P. aeruginosa, TssL and TssK from A. baumannii. Nuestro estudio reveló varias características notables en la estructura que podrían relacionarse con el papel a nivel funcional de los dos segmentos principales de VgrG1: la cabeza ("head") como el armazón de carga y la aguja (β-roll spike) con implicaciones en procesos de punción de la membrana celular y como portador de toxinas.
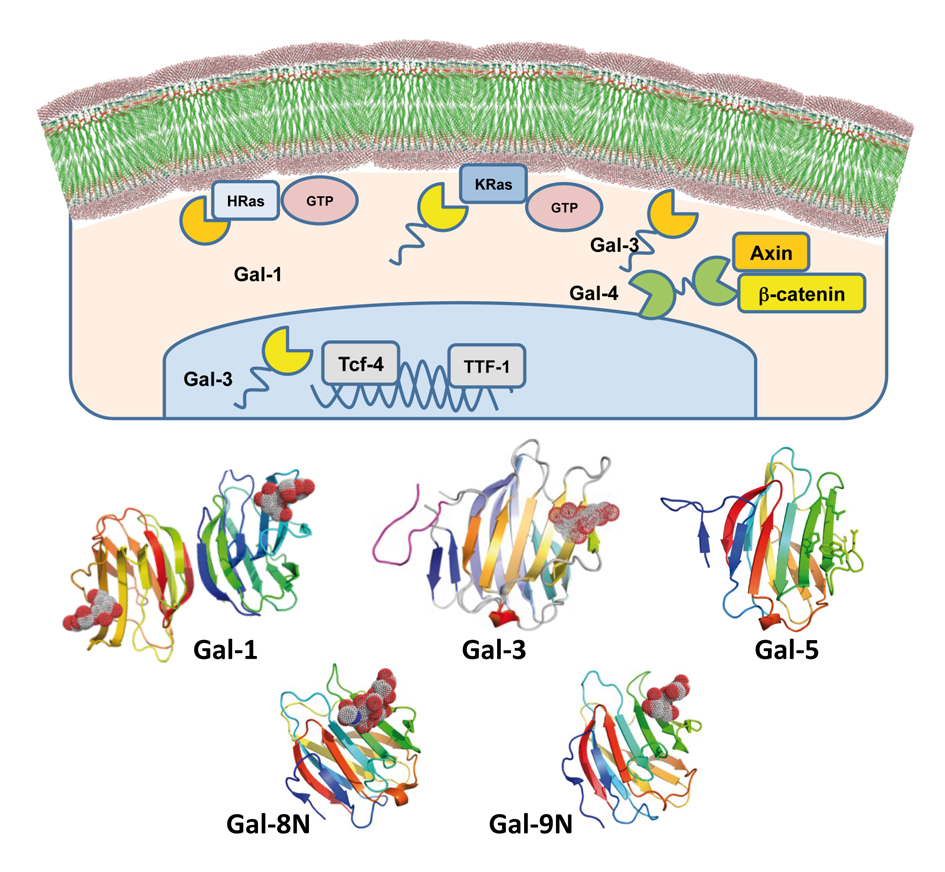
Galectinas. Las galectinas reconocen y se unen a β-galactósidos presentes en la gran diversidad de estructuras de glicanos localizados como glicoconjugados de la superficie celular. El reconocimiento e interpretación del código (carbohidratos) localizado en estos glicoconjugados se lleva a cabo mediante su interacción con proteínas, y la lectura de este código es esencial en una amplia gama de procesos biológicos normales, así como en la patogénesis de varias enfermedades humanas. Las galectinas están estrechamente relacionadas con estas patologías, incluyendo su sobreexpresión en células cancerosas y en células estromales asociadas al cáncer, particularmente en aquellos tipos celulares que normalmente no expresan la galectina específica. El objetivo final de este proyecto es caracterizar, estructural y bioquímicamente, las propiedades de unión de las galectinas humanas: Gal-1, Gal-3, Gal-4 y Gal-8 a una amplia variedad de glicostructuras mono- y multivalentes.
Miembros
| Antonio Romero Garrido |
| Francisco Javier Medrano Martin |
| Elena Santillana Heras |
| Ana Agueda Gonzalez Martinez |
| Andrea Cerda Ferre |




