Los trastornos neurodegenerativos son afecciones patológicas complejas que implican, entre otros procesos, la pérdida sináptica y la muerte de las células neuronales que conducen al deterioro de la estructura y función neuronal. Las enfermedades neurodegenerativas son la segunda causa principal de muerte y una de las principales causas de discapacidad. El desarrollo de estrategias para curar o al menos retrasar la progresión de las enfermedades neurodegenerativas se ha visto obstaculizado por su etiología diversa y naturaleza compleja, y por la limitada capacidad regenerativa de las neuronas. Por tanto, existe una necesidad urgente de intervenciones médicas eficaces. Como parte del sistema nervioso central (SNC), la retina comparte múltiples características fisiopatológicas con el cerebro, y las enfermedades neurodegenerativas de la retina, como las que afectan al cerebro, se caracterizan por deficiencia sináptica y muerte de células neuronales. La retinosis pigmentaria (RP) se refiere a un grupo de distrofias retinianas hereditarias que son clínicamente similares a pesar de surgir de un gran conjunto de mutaciones genéticas; se han identificado más de 60 genes y 3000 mutaciones hasta la fecha (https://sph.uth.edu/retnet/disease.htm). La RP es la causa más común de ceguera hereditaria en personas entre 20 y 60 años. Está categorizada como una enfermedad rara (prevalencia 1/ 3500-4000) y afecta a alrededor de 2 millones de personas. La mayoría, si no todas las formas de RP, comparten mecanismos moleculares y celulares que incluyen inflamación, activación macro y microglial, y pérdida de células fotorreceptoras. Actualmente, la RP es una enfermedad incurable y que no se puede prevenir. La terapia génica sería el tratamiento definitivo ideal; sin embargo, la complejidad genética de la etiología de la RP requiere el desarrollo de tratamientos dirigidos a mecanismos patológicos comunes independientemente de la mutación causante.
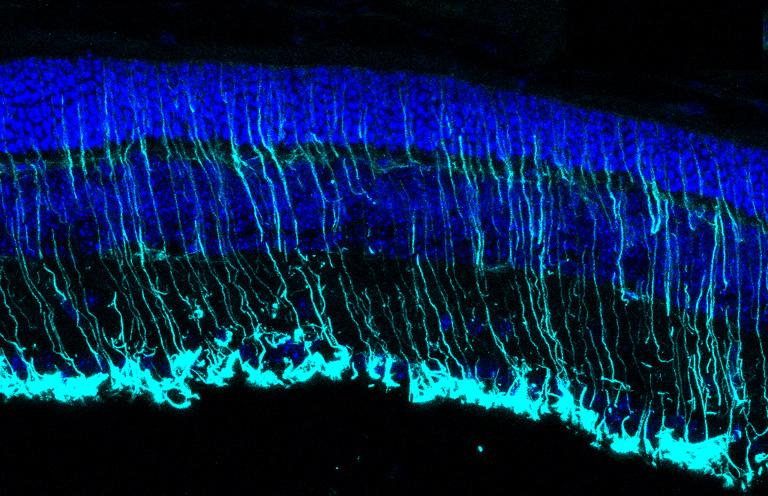
Los procesos neuroinflamatorios constituyen una causa común para los trastornos cerebrales y de la retina; sin embargo, los intentos de interferir en modelos animales con algunos aspectos de la respuesta inflamatoria han dado resultados a veces contradictorios. Esto destaca la necesidad de incrementar el conocimiento de los mecanismos patológicos de la enfermedad antes de considerar nuevos enfoques terapéuticos. En nuestro grupo abordamos tres elementos clave del proceso inflamatorio asociado no solo a las distrofias retinianas sino también a otras enfermedades neurodegenerativas: i) los receptores de respuesta inmune innata, incluidos los receptores tipo Toll (TLR). La activación de TLR, ya sea por patrones moleculares asociados a patógenos (PAMP) o por patrones moleculares asociados a daños (DAMP), genera una respuesta inflamatoria. La activación de TLR parece mostrar efectos duales, ya sea protección o exacerbación de patologías neurodegenerativas. ii) alarminas, como la proteína HMGB1 (del inglés High Mobility Group Box1) que pueden actuar como una señal de daño. HMGB1 es una chaperona nuclear que tras el daño celular se puede liberar al medio extracelular, donde activa los receptores de respuesta inmune innata como TLR. iii) el sistema del complemento, otro actor de la respuesta inmune innata que ha estado involucrado en procesos neurodegenerativos. En estos estudios emplearemos dos modelos de RP no relacionados genéticamente, los ratones rd10 y P23H, para sustentar nuestras observaciones como procesos independientes de la mutación causante. Investigaremos si la modulación de aquellos procesos identificados como relevantes puede constituir una terapia potencial para el tratamiento de la RP.
Además, basados en nuestros estudios previos de desarrollo neural, hemos ensayado nuevas estrategias neuroprotectoras. Dado que el precursor de insulina proinsulina promueve la diferenciación neuronal y regula negativamente la muerte celular del desarrollo, comenzamos a explorar su posible aplicación terapéutica en enfermedades neurodegenerativas. Comprobamos que la proinsulina retrasaba la muerte de las células fotorreceptoras en varios modelos de RP en ratones y ratas, prolongando su función visual. Además, la proinsulina atenuó el deterioro cognitivo asociado a la edad.
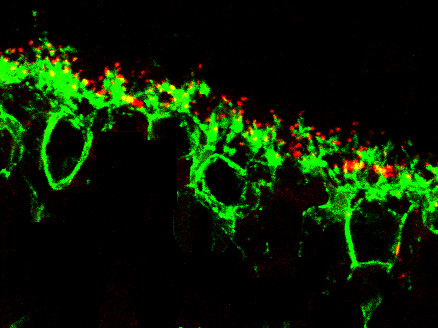
Nuestra línea de investigación global tiene como objetivo avanzar en el conocimiento de las alteraciones celulares y moleculares asociadas a la RP y por extensión al proceso neurodegenerativo, así como a identificar nuevos objetivos farmacológicos y realizar pruebas de concepto iniciales para posibles terapias de RP.
· Sánchez-Cruz A, Villarejo-Zori B, Marchena M, Zaldivar-Díez J, Palomo V, Gil C, Lizasoain I , de la Villa P, Martínez A, de la Rosa EJ and Hernández-Sánchez C. [2018]. Modulation of GSK-3 provides cellular and functional neuroprotection in the rd10 mouse model of retinitis pigmentosa. Mol Neurodegener Apr 16;13(1):19. DOI: 10.1186/s13024-018-0251-y.
Platón-Corchado M, Barcelona PF, Jmaeff S, Marchena M, Hernández-Pinto AM, Hernández-Sánchez C, Saragovi HU, de la Rosa EJ. [2017]. p75NTR antagonists attenuate photoreceptor cell loss in murine models of retinitis pigmentosa. Cell Death Dis. 2017 Jul 13;8(7):e2922. DOI: 10.1038/cddis.2017.306.
·
· Corpas R, Hernández-Pinto AM, Porquet D, Hernández-Sánchez C, Bosch F, Ortega-Aznar A, Comellas F, de la Rosa EJ, Sanfeliu C. [2017]. Proinsulin protects against age-related cognitive loss through anti-inflammatory convergent pathways. Neuropharmacology. 2017 Sep 1;123:221-232. DOI: 10.1016/j.neuropharm.2017.06.014.
- Isiegas C, Marinich-Madzarevich JA, Marchena M, Ruíz JM, Cano MJ, de la Villa P, Hernández-Sánchez C, de la Rosa EJ, De Pablo F. [2016]. Intravitreal injection of proinsulin-loaded microspheres delays photoreceptor cell death and vision loss in the rd10 mouse model of retinitis pigmentosa. Invest. Ophtalmol. Vis. Sci. 57, 3610-18. DOI: 10.1167/iovs.16-19300.
Participantes: Alonso Sánchez, Cayetana Murillo, Mateo Pazo González and Noelia Pimentel Mayordomo.
Colaboradores: Pedro de la Villa (Universidad de Alcalá), Fátima Bosch (Universidad Autónoma de Barcelona), Nicolás Cuenca (Universidad de Alicante), Regina Rodrigo (Hospital La Fe), Ana Martínez (CIB), Ignacio Lizasoain (Universidad Complutense), Uri Saragovi (McGill University) and Patricia Becerra (NEI-NIH).
Responsables: Enrique J de la Rosa and Catalina Hernández-Sánchez

