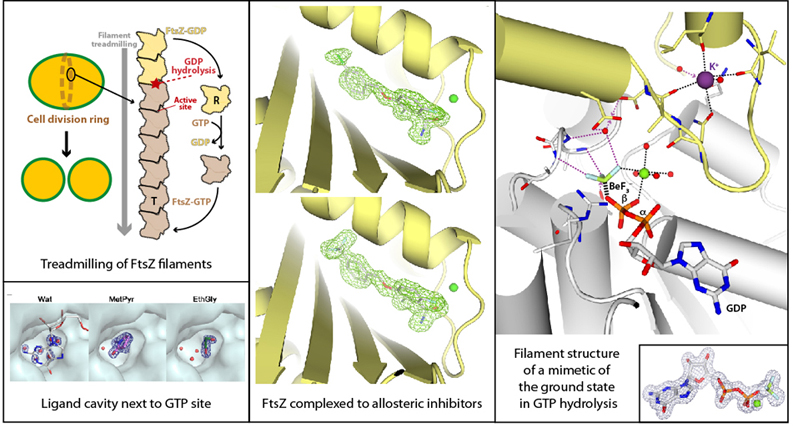
La división celular es un proceso biológico esencial que permite la propagación de los organismos vivos. En las bacterias, el primer paso de la división celular es la formación de una estructura en forma de anillo en el centro de la envoltura celular, donde la proteína FtsZ desempeña un papel central. FtsZ es un homólogo ancestral de la tubulina que se polimeriza en presencia de GTP en filamentos polares que se trepidan tras la hidrólisis de GTP. Debido a su papel esencial en la división celular bacteriana, la inhibición de FtsZ se considera una estrategia adecuada para combatir las infecciones bacterianas. Nos centramos en el estudio de FtsZ de Staphylococcus aureus, un importante patógeno humano que presenta resistencia a los antibióticos disponibles.
Utilizamos cristalografía de rayos X y ensayos bioquímicos para estudiar diferentes estados de plegamiento de FtsZ sola y en complejo con pequeños ligandos, lo que reveló una cavidad junto al bolsillo de unión a nucleótidos [FEBS J, 2020]. También aplicamos la cristalografía de rayos X para determinar estructuras de FtsZ en complejo con nuevos inhibidores, que se unen a un bolsillo alostérico y presentan actividad bactericida [J Med Chem, 2021]. Además, obtuvimos estructuras de alta resolución de FtsZ en complejo con diferentes análogos de nucleótidos y cationes, incluidos miméticos de los estados básico y de transición de la catálisis, que arrojan luz sobre el mecanismo de la dinámica de los filamentos de FtsZ [PLoS Biol, 2022]. La comparación con las estructuras del homólogo arqueano de FtsZ nos permitió identificar los sitios activos conservados de la GTPasa, probablemente heredados del ancestro común [FEBS J, 2023].