
Un trabajo recientemente publicado en la revista Frontiers in Immunology por el grupo liderado por el Prof. Vicente Larraga en el Centro de Investigaciones Biológicas Margarita Salas (CIB-CSIC) presenta el desarrollo de una vacuna de ADN que protege completamente a ratones contra una dosis letal del virus SARS-CoV-2. Los resultados obtenidos en modelo murino muestran que la replicación viral se controló por completo en los pulmones, el cerebro y el corazón de los ratones vacunados, convirtiéndola en una prometedora candidata para la protección contra la COVID-19.
La vacuna está constituida por un plásmido de ADN, denominado pPAL, carente de genes de selección basados en resistencia a antibióticos, y desarrollado en el laboratorio del Prof. Larraga para la obtención de una vacuna frente a la leishmaniosis canina.
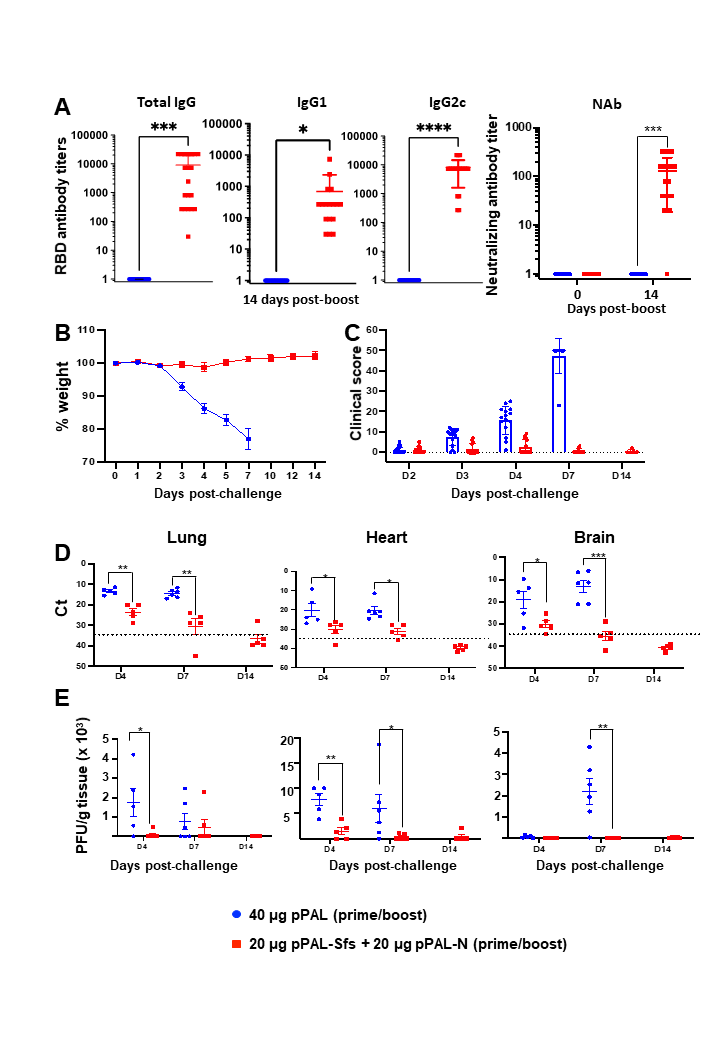
Este plásmido se ha adaptado para la generación de una vacuna frente al SARS-CoV-2 con la introducción del gen codificante del antígeno S de superficie del virus, así como el gen de la proteína N de la nucleocápsida. La formulación final es una mezcla de ambos plásmidos. Mientras que la proteína de superficie tiene una gran frecuencia de mutación, la proteína de la nucleocápsida es muy estable y contiene secuencias activadoras de células T.
La vacuna desarrollada por Alcolea et al. induce la producción de las proteínas en células embrionarias de riñón humano, HEK293, en cultivo. Su administración in vivo, por vía intramuscular con electroporación en dos dosis, induce la producción de títulos elevados de anticuerpos específicos que neutralizan el virus SARS-CoV-2. También inducen la activación de las células CD4+ y CD8+. En las pruebas de protección, el candidato vacunal protege al 100% de los signos clínicos de la COVID-19 a los ratones kh18 ACE2, modelo animal de esta enfermedad, frente a dosis mortales (105 pfus) del virus, tanto de la cepa Wuhan 1 como de la variante Delta del mismo.
Los estudios muestran que los animales tratados no muestran signos de la enfermedad durante la prueba (14 días) al contrario que los controles no vacunados que pierden peso a partir del segundo día y mueren el día siete. Además, la vacuna induce una reducción muy importante de la carga viral en los órganos diana de la enfermedad (pulmón, corazón y cerebro), no solo en su detección por PCR sino también como virus activos in vitro.
En conjunto, los resultados demuestran que esta vacuna induce una protección muy elevada en modelo murino, y ha superado también pruebas de toxicidad en perros. Adicionalmente, es termotolerante, lo que permitiría su distribución en países en los que mantener la cadena de frío es difícil, y se está probando su administración por vía subcutánea con un procedimiento “sin aguja”. Estos factores hacen de este candidato una vacuna prometedora frente a la COVID-19.
Referencia: Non-replicative antibiotic resistance-free DNA vaccine encoding S and N proteins induces full protection in mice against SARS-CoV-2. Pedro J. Alcolea, Jaime Larraga, Daniel Rodríguez-Martín, Ana Alonso, Francisco J. Loayza, José M. Rojas, Silvia Ruiz-García, Andrés Louloudes-Lázaro, Ana B. Carlón, Pedro J. Sánchez-Cordón, Pablo Nogales-Altozano, Natalia Redondo, Miguel Manzano, Daniel Lozano, Jesús Palomero, María Montoya, María Vallet-Regí, Verónica Martín, Noemí Sevilla and Vicente Larraga (2022) Frontiers in immunology. 13:1023255. DOI: 10.3389/fimmu.2022.1023255

