Responsable/s del laboratorio
intro
La mayoría de las células utilizan GTPasas que ensamblan para segregar sus cromosomas, para dividirse o como componentes del citoesqueleto. La superfamilia de tubulina-FtsZ incluye la alfabeta-tubulina, gamma-tubulina, la tubulina bacteriana BtubA/B, la proteína de división bacteriana FtsZ, CetZ de arqueas y las nuevas TubZs de plásmidos y fagos. Nuestro trabajo se centra en comprender como funcionan estas máquinas de ensamblaje e inhibirlas con pequeñas moléculas que puedan conducir a nuevos antibióticos y mejores agentes antitumorales. Para ello empleamos diversos abordajes bioquímicos, biofísicos, bioinformáticos y celulares en el CIB y grupos colaboradores.
Vea por favor esta página actualizada en inglés
Acceso directo: http://www.cib.csic.es/tubulinas
Contacto: j.m.andreu@cib.csic.es
Publicaciones: http://scholar.google.es/citations?hl=en&user=FyBdDrgAAAAJ&view_op=list_works&sortby=pubdate

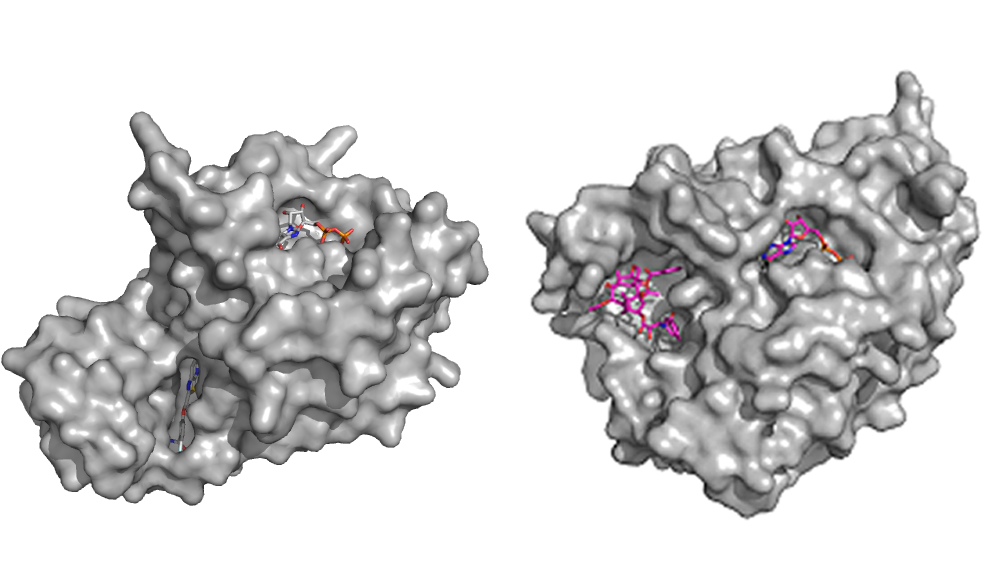
PC190723 GDP taxol GDP
Cavidades de unión de ligandos en FtsZ (izquierda) y beta-tubulina (derecha)

TubZ de bacteriofago cs-t de Clostridrium botulinum


