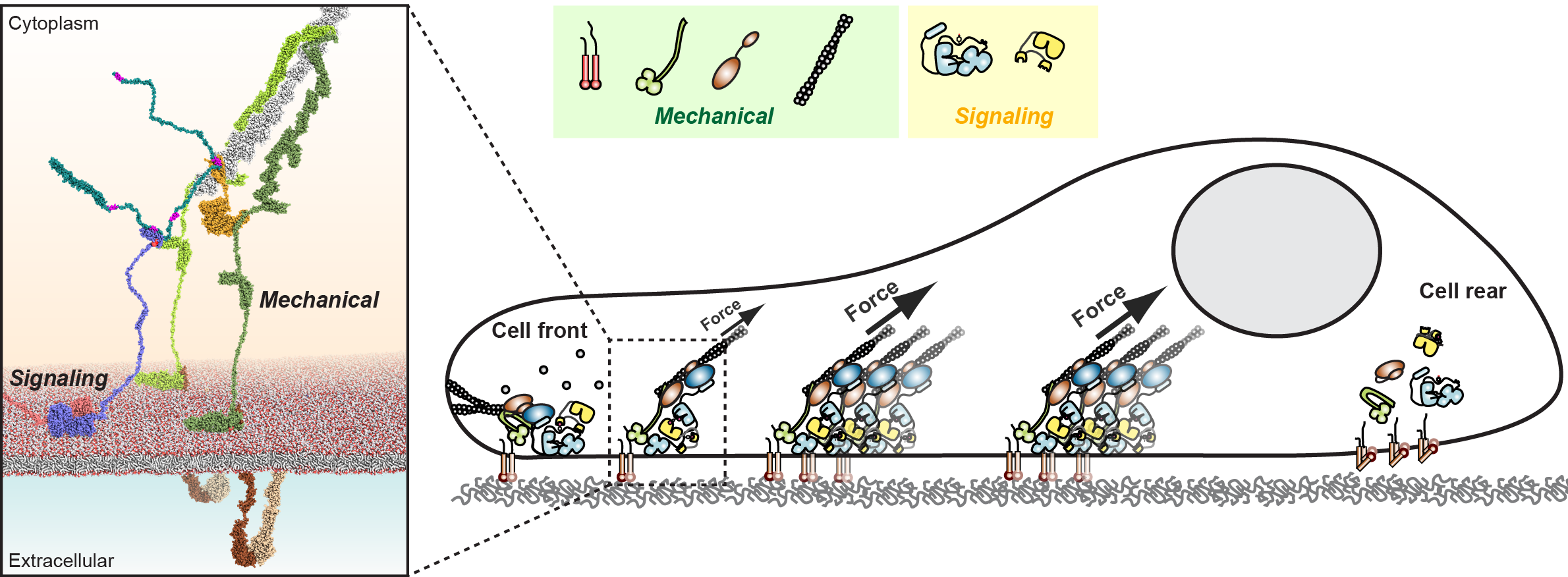
Un trabajo publicado en la revista Cell Commun. Signal. por el grupo dirigido por el Dr. Daniel Lietha en el Centro de Investigaciones Biológicas Margarita Salas (CSIC) propone un modelo atómico para la activación de la Quinasa de Adhesión Focal (FAK, por sus siglas en inglés) que muestra una conexión regulada por fosforilación entre los componentes de señalización y transducción de fuerza en las adhesiones focales (FAs) permitiendo la activación inducida por fuerza de la señalización de FA.
En los organismos superiores, las células han adquirido la capacidad de migrar a lugares específicos del cuerpo. En los organismos sanos, el movimiento celular coordinado es importante durante el desarrollo o la cicatrización de heridas, y las células cancerosas pueden aprovecharse de esta capacidad para la invasión durante la enfermedad y la metástasis.
Durante la migración celular, se generan fuerzas mecánicas que, por un lado, proporcionan tracción celular para el movimiento y, por otro, activan un aparato de señalización asociado. Estas señales son esenciales para una migración celular coordinada y productiva, controlando la formación de nuevos puntos de tracción adhesiva en la parte delantera de la célula y la disociación en la parte trasera. La quinasa de adhesión focal (FAK) es una molécula de señalización clave en las adhesiones focales (AF) que orquesta la formación, maduración y recambio del complejo de AF.
Una cuestión que se plantea desde hace tiempo en este campo es cómo la fuerza mecánica generada para la migración celular se convierte en señales bioquímicas. En esta publicación, los autores llevan a cabo un enfoque multidisciplinar para responder a esta pregunta.
Combinando técnicas bioquímicas, biofísicas, estructurales y de biología celular, Díaz-Palacios et al. generaron un modelo atómico de cómo las proteínas clave para las funciones mecánicas y de señalización en la migración celular pueden conectarse y explicar cómo las fuerzas aplicadas activan las proteínas de señalización. Han demostrado que la conexión está altamente regulada por un evento específico de fosforilación y han confirmado que tanto la conexión como la fosforilación son necesarias para activar estas proteínas de señalización en las células.
La comprensión de este mecanismo en detalle atómico permitirá el futuro diseño de nuevas estrategias para interferir con la migración celular aberrante en las células cancerosas, y proporcionando potencialmente dianas para nuevas terapias que prevengan la invasión del cáncer y la metástasis en cánceres avanzados.
El trabajo ha sido financiado por la Ayuda de Generación de Conocimiento PID2021-127058NB-I00 (D.L.) del Ministerio de Ciencia e Innovación, cofinanciada por el Fondo Europeo de Desarrollo Regional (FEDER).
Referencia: Phospho-regulated tethering of focal adhesion kinase to vinculin links force transduction to focal adhesion signaling. Karen Diaz-Palacios, Pilar López Navajas, Bárbara Rodrigo Martín, Ruth Matesanz, Juan R. Luque-Ortega, Asier Echarri, and Daniel Lietha (2025) Cell Commun. Signal. 23:190 https://doi.org/10.1186/s12964-025-02201-3

